PROPIEDADES FISICAS
La plata es un metal blanco, blando, algo más denso que el cobre, si consideramos como 100 la conductibilidad térmica de la plata, el cobre, que es el metal que le sigue tiene 73, el oro 53 y el aluminio 31, mientras que todos los demás metales comunes poseen menor conductibilidad térmica. La presencia de pequeñas cantidades de As, Sb, Bi y Pb hace que la plata sea quebradiza.
La plata tiene 10,5 de densidad y por el laminado alcanza a 10,6. Según G.Rose, la densidad varía de 10,514 a 10,619 a 14°C y de acuerdo a Matthiessen es de 10,468 a 13°C. Cristaliza en el sistema regular. Su peso atómico y número atómico es de 107,88 y 47, respectivamente. La temperatura de fusión de la plata es de 960,5°C y la de ebullición es de 1.955°C. Sin embargo, la plata empieza a desprender vapores a más baja temperatura, los que se hacen sensibles entre 1.200 a 1.500 °C. La plata es el conductor de la electricidad más perfecto comparada con otros metales.
La plata es menos maleable que el estaño, plomo, zinc y oro, pero más maleable que el cobre, aluminio, hierro y platino.
PROPIEDADES QUIMICAS
La plata no se oxida por el aire seco o húmedo, el oxígeno y el agua, y muy ligeramente cuando sube la temperatura. El hidrógeno sulfurado (H2S) ennegrece la plata, debido a la formación de sulfuro de plata.
Los álcalis cáusticos, carbonatos alcalinos y el clorato de potasio, no atacan a la plata. La plata metálica es poco atacada por el ácido clorhídrico y el sulfúrico diluido, aún en ebullición. El ácido sulfúrico disuelve la plata sólo cuando es concentrado y caliente y el ácido nítrico aun diluido,disuelve con mucha facilidad.
El sulfato de plata es soluble en 68,6 partes de agua a 100°C y su solubilidad aumenta en presencia de ácido libre.
El sulfato de plata funde a 660°C y a 1035°C se descompone en plata libre, anhidrido sulfuroso y oxígeno.
El plomo metálico descompone sólo parcialmente el sulfuro de plata, dando lugar a la formación de una mata que contiene los dos sulfuras.
XAg2S + yPb = a(Ag2Pb) + b(PbS) + c(Ag2S,PbS)
La presencia del óxido de plomo (PbO) dificulta la formación de la mata por efecto de la oxidación del azufre del sulfuro de plata Ag2S.
El cobre actúa de la misma forma que el plomo metálico; forma la mata de cobre y plata, mientras que el óxido de cobre dificulta la formación de esta mata.
El hierro descompone completamente el sulfuro de plata cuando actúa a alta temperatura.
Ag2S + Fe = Ag2 + FeS
El nitrato de plata (AgNO3): Esta sal de plata es soluble en el agua. A continuación se muestra su solubilidad a diferentes temperaturas del líquido elemento.
100 partes de agua a 0°C disuelven 115 partes de AgNO3
100 partes de agua a 10°C disuelven 160 partes de AgNO3
100 partes de agua a 20°C disuelven 215 partes de AgNO3
100 partes de agua a 54°C disuelven 500 partes de AgNO3
100 partes de agua a 100°C disuelven 910 partes de AgNO3
El nitrato de plata se obtiene por la acción directa del ácido nítrico diluido sobre el metal:
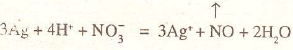
Al evaporar la disolución se depositan cristales incoloros, que funden a 208,6°C. El sólido fundido puede moldearse en barritas delgadas (piedra infernal), empleadas como cáustico en cirugía.
Los cianuros alcalinos la disuelven al estado de cianuros dobles. La reacción es la siguiente:
2Ag + 4KCN + H2O + O = 2KAg(CN)2 + 2KOH
Para que esta reacción tenga lugar, se requiere la presencia del agua y del oxígeno.
El sulfuro de plata es soluble en el hiposulfito doble de cobre y sodio, reacción que se aprovecha en algunos tratamientos metalúrgicos.
Ag2S + Na2Cu2(S2O3)2 = Na2Ag2(S2O3)2 + Cu2S
El mercurio descompone el sulfuro de plata en frío:
Ag2S + Hg = HgS + Ag2
Los hiposulfitos y los cianuros se emplean en la metalurgia de la plata para disolver el cloruro de este metal obtenido por tostación clorurante, empleando como reactivo el cloruro de sodio. Las reacciones son las siguientes:
2AgCl + 2Na2S2O3 = Ag2Na2(S2O3) + 2NaCl
2AgCl + 3CaS2O3 = CaCl2 + Ag2Ca2(S2O3)2
AgCl + 2KCN = AgCN, KCN + KCl
El cloruro de plata es insoluble en agua.
El mercurio reacciona con el cloruro de plata, de acuerdo a la siguiente ecuación química:
AgCl + Hg = Ag + HCl
De acuerdo a los estudios de H.C. Hahn y W.M. Curtís, la solubilidad del cloruro de plata en las soluciones de varios cloruros es como sigue:
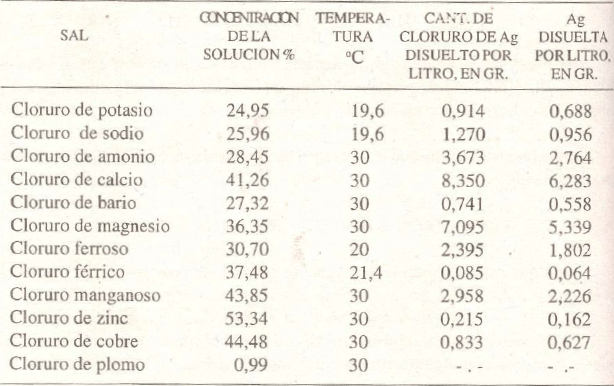
Como se puede ver de los anteriores datos, el cloruro de plata es más soluble en soluciones de cloruro de amonio, hierro y manganeso que en soluciones de sal común (Na Cl). Pero las soluciones de cloruro de calcio y de magnesio son las que mejor disuelven el cloruro de plata.
Según H.C. Hahn, 100 cc. de solución saturada de cloruro de calcio a 0°C contiene 47,53 gramos de sal. Un litro de esta solución puede tomar las siguientes cantidades de cloruro de plata:
A 0°C; 2,835 gr.; encima de 0°C; 4,637 gr.; a 100°C ; 8,147gr.
El sulfato de plata (Ag2SO4) se produce disolviendo la plata en ácido sulfúrico concentrado y caliente. Este sulfato se forma tambiém por el tostado sulfatante de las matas cuprosas argentíferas y por la acción del sulfato férrico sobre la plata.
Fe2(SO4)3 + 2Ag = Ag2SO4 + 2FeSO4
El óxido de plata, Ag2O: Se produce en forma de un precipitado pardo cuando se añade hidróxido sódico a una disolución de una sal de plata. El hidróxido de plata, AgOH, es inestable y se descompone en óxido y agua:
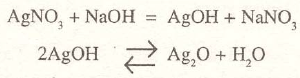
El ion plata, Ag+, se combina con al amoniaco, NH3, para formar el ion complejo Ag( NH3)2 , cuya constante de inestabilidad a 25°C es 6,8.10-8, se tiene:
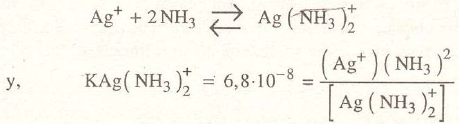
En concreto, las constantes de inestabilidad de algunos iones complejos de plata a 25°C, son:

Aleaciones de la plata
La plata se alea fácilmente con la mayor parte de los metales. Las aleaciones más importantes son las que forma con el cobre, las cuales se emplean en lugar de plata pura con el objeto de aumentar su dureza.
La plata tiene aun mayor afinidad con el zinc que con el plomo y esta propiedad se aprovecha en algunos procedimientos metalúrgicos para extraer del plomo la plata contenida (Proceso Parkes).
Las aleaciones de la plata con el cobre, plomo, zinc y estaño son más fusibles que los metales puros y esta condición es también utilizada en metalurgia.
Arseniato y antimoniato de plata
Estos compuestos se forman durante el tostado de los minerales argentíferos y son estables a alta temperatura.
Son reducidos por el plomo y el carbón actuando en caliente. En la reducción por el plomo, la plata queda disuelta en este metal, la separación implica el uso del Procedimiento Parkes.
El zinc, hierro y el cobre precipitan la plata metálica de las soluciones del sulfato. El sulfato ferroso también precipita la plata de las soluciones del sulfato. El sulfato de plata es difícilmente soluble en agua fría, fácilmente soluble en agua caliente y muy fácilmente soluble en ácido sulfúrico.
CONSIDERACIONES GENERALES
La plata sigue ocupando un lugar predominante entre todos los metales preciosos, ya que hace años, la producción no alcanza a cubrir la demanda, de modo que hoy se recurre a la recuperación secundaria de plata a partir de los desperdicios de la fotografía, electrónica, joyería, aleaciones especiales y otros.
Una evaluación de los recursos mundiales de plata, indica que la producción proveniente de las reservas minerales y la adicional obtenida por procesamiento de desperdicios podría cubrir la demanda acumulativa industrial pronosticada para el año 2.000, pero probablemente a precios más altos que los actuales.
La demanda de plata primaria, en los Estados Unidos de Norte América, ha sido pronosticada para el año 2.000 de 140 a 280 millones de onzas comparadas con 90 millones de opzas de 1968. En el resto del mundo, para el mismo año se estima de 362 a 792 millones de onzas troy; comparada con 225 millones de onzas de 1968.
La plata probablemente fue descubierta después que el oro‘ó cobre, pero ya era conocida y apreciada por la humanidad miles de años antes.
El descubrimiento de utensilios y adornos de plata en el Asia Menor, evidencia de que este metal noble ya fue usado entre los años 2.500 y 3.000 antes de Cristo.
En un principio, la plata fue encontrada como metal nativo o como cloruro de plata, el cual pudo ser convertido en un bullión utilizando el carbón vegetal como combustible.
Los romanos utilizaron la plata como base para su sistema monetario, razón por la cual fue intensamente explotada en la era del Imperio Romano.
Igualmente, durante la Edad Media, fue extraída en algunos países de Europa, aunque en cantidades relativamente reducidas.
El auge de la producción de plata en el mundo comenzó después del descubrimiento del Continente Americano, donde inmensos y ricos depósitos de plata fueron desarrollados por los primeros conquistadores.
Entre los famosos yacimientos argentíferos encontrados y explotados en el año 1,500, se cuentan el Cerro Rico de Potosí (Bolivia) y el Pachuca y Guanajuato en México.
Bolivia, con una producción total de plata superior al billón de onzas ocupó el primer lugar en el mundo hasta el año 1700; posteriormente, desplazado por Estados Unidos de Norte América, país que se convirtió en el principal productor mundial desde 1871 hasta el año 1900 aproximadamente, después del descubrimiento del Comstock Lode en Nevada, en el año 1859. Entre los años 1900 y 1968, México se situó en el primer puesto con una producción de 40 millones de onzas, hasta que Canadá incrementó su explotación en 1968 en más del 25% con respecto a la de 1967, la cual le permitió colocarse en primer plano con una producción de 45,6 millones de onzas.
Los minerales que contienen plata son clasificados en base a la terminología y convenios contractuales de los fundidores y la recuperación del metal en los procesos metalúrgicos. La proporción de plata en las monedas, joyería, para vajilla, etc. se expresa comúnmente en partes por mil. La plata pura o fina tiene 100% de Ag, o sea 1,000 milésimos, la plata esterlina británica tiene 925 milésimos de plata (922,5%) y 75 partes de cobre (7,5%).
La plata de acuñación en los Estados Unidos de Norte América, contiene 90% de plata y el 10% de cobre. Esta composición tambiém constituye la plata esterlina de los Estados Unidos. En 1964 esta aleación fue sustituida por una de cobre-níquel que contiene 75% de Cu y 25% de Ni y otra que contiene 40% de Ag y 60% de Cu.
MINERALES DE PLATA
La plata normalmente se presenta en depósitos minerales asociados con otros como: plomo, cobre, zinc, antimonio y oro. Los minerales de plata más importantes son los siguientes:
Plata nativa Ag
Andorita AgPbSb3S6
Argentita Ag2S
Polibasita (Ag2Cu)16Sb2S11
Prousita Ag3AsS3
Estefanita Ag3SbS4
Pirargirita Ag3SbS3
Querargirita AgCl
Miargirita AgSbS2
Otros minerales, tales como: la tetraedrita argentífera Cu3(SbAs)S3 y galena argentífera (PbS) tienen parte de retículos espaciales reemplazados con plata.
Los minerales de plata han sido depositados en rocas de varias edades geológicas, como el Precámbrico, Cretásico y el Terciario.
Minerales de plata en Bolivia
Andorita: AgPbSb3S6
Este mineral es peculiar de los yacimientos sub-volcánicos argento-estañíferos bolivianos, pero se ha presentado en cantidades económicas solamente en las vetas Purísima, Bronce, San Luis de la mina San José de Oruro, etc.
En cantidades muy reducidas se ha presentado también en otros yacimientos sub-volcánicos. Lindgreen y Creveling describen una muestra procedente del socavón Santa Rita del Cerro de Potosí: igualmente, se ha encontrado en las vetas de pirita de Llallagua y en la veta Embudo de Colquechaca.
Argentita: Ag2S, con 87% de plata.
En el pasado probablemente la argentita fue un mineral muy difundido en los llamados mulatos formados en la zona de cementación.
En Colquechaca, en las vetas Embudo y Gallofa se encontró argentita junto con plata nativa, pirargirita y polibasita, constituyendo cristales y/o formas masivas compactas, frecuentemente bandeadas. En el distrito de Porco en la antigua mina de plata de Tornohuaico se presentaba la argentita de modo similar que en Colquechaca.
Querargirita o Cerargirita: AgCl
La querargirita se llama también plata córnea. En la época de la Colonia este mineral era el más importante de las minas de Porco, Oruro, Potosí, Colquechaca y muchas otras en el Sud y Ñor Lípez.
La abundancia de los minerales pobres con plata córnea en la zona de oxidación del Cerro Rico de Potosí, constituyó la enorme riqueza que fue explotada en forma intensa desde la implantación del procedimiento de amalgamación en 1640.
Pirargirita: Ag3SbS3
Este mineral se conoce también con el nombre de rosicler de plata. En el tiempo del coloniaje, en Bolivia era un mineral abundante en los distritos de Potosí, Tatasi-Portugalete, Porco, Colquechaca y Carangas. Actualmente las zonas ricas en pirargirita, por su intensa explotación en el pasado, han desaparecido casi por completo y las muestras de este mineral sólo se pueden observar en los museos mineralógicos y algunas colecciones privadas.
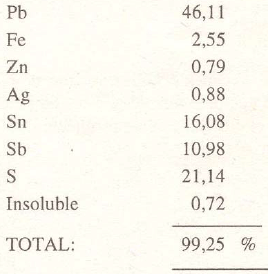
Cilindrita: Pb3Sn4Sb2S14
Es un mineral netamente boliviano, fue descubierto por Frenzel en las muestras de un lote que provenía de la mina Santa Cruz de Poopó. La muestra analizada por Frenzel dió el siguiente resultado:

En los desmontes de la mina Gallofa y otras minas de Carguaycollo, Ahlfeld encontró muestras de cilindrita junto con franckeita y wurtzita.
En la mina Trinacría (Poopó) se presentó en mayor cantidad formando clavos verticales en una veta de blenda y pirita.
También se presentó la cilindrita acompañando a la franckeita en tubos delgados en las minas San José y Porvenir de Huanuni.
Franckeita: Pb5Sn3Sb2S14
El mineral fue descubierto por Stelzner en las muestras de la mina Animas-Chocaya.
La franckeita se presenta en Tatasi, en Vetillas del distrito de San Vicente, en Carguaicollo, Poopó, María Francisca (Huanuni), Llallagua, Colquechaca y mina Cerro Grande de Colcha.
En Huanuni, Poopó, Carguaicollo, mina San José y Asunta, la franckeita ha sido explotada por su elevada ley de plata. En la mina San José se instaló una planta de flotación para la recuperación de la franckeita, pero debido al agotamiento de dicho mineral en el yacimiento, el ingenio fue desmontado. Las minas de los otros distritos han sido también abandonadas por su total agotamiento.
El análisis de una muestra de la mina Porvenir de Huanuni (Brendler en Moritz) dio el resultado que sigue:
Galena argentífera: PbS
La galena argentífera contiene 86,6 % de Pb, casi siempre con 0,01 y 0,3% de plata pero que algunas veces puede llegar a 1 % y más.
Las vetas con galena argentífera están muy difundidas en los yacimientos sub-volcánicos, sea con minerales de plata como en Pulacayo y Tatasi o con casiterita como en el Cerro Rico de Potosí, San José de Oruro, Chocaya, Porco, Colquechaca, etc.
La galena se presenta con blenda, calcopirita, pirita y minerales de plata.
Tetraedrita: Cu3SbS3
Este mineral se llama también cobre gris, es el más importante de Bolivia. En muchos yacimientos explotados por plata en épocas anteriores era el mineral principal, así en Pulacayo la producción de plata provenía casi enteramente de tetraedrita. Este mineral fue explotado también en el Cerro Rico de Potosí, Colavi, Maragua, Ubina, Mina San José (Oruro), etc.
PLATA NATIVA
Muchas veces asociada a otros metales como oro, cobre, mercurio, etc. En el pasado la plata nativa era común e importante desde el punto de vista económico en las zonas superficiales de muchos depósitos argentíferos de la parte sur y central de Bolivia, distinguiéndose entre ellos, el Cerro Rico de Potosí, Cerro de Oruro, Chocaya, Tatasi, Porco, San Vicente, San Cristóbal, Carangas, etc.
La plata nativa fue intensamente explotada en la época de la colonia y también posteriormente; hoy en día, raras veces se encuentra en estado nativo este metal precioso.
La plata nativa estaba limitada solamente a las partes de oxidación de las vetas; no se ha presentado más en los planos inferiores de las minas, donde predominan las especies sulfuradas.
Miargirita: AgSbS2
Plata antimoniada y sufurada Ag2S, Sb2S3, contiene 32 a 36% de plata. Este mineral se presenta en Aullagas (Potosí) y la mina Itos de Oruro.
Aramayoita: Ag(SbBi)S2
Se presenta en la mina Animas, Chocaya, provincia Sud Chichas del departamento de Potosí, asociada con pirita, tetraedrita y estanina.
TRATAMIENTO METALURGICO DE LOS MINERALES DE PLATA
En el tratamiento metalúrgico de los minerales de plata, pueden considerarse los siguientes métodos:
1° Minerales que contienen la plata como metal secundario
Fundición para cobre o plomo metálicos y separación posterior de la plata.
En este caso, se sigue los tratamientos metalúrgicos que corresponden al metal principal, para después proceder a la recuperación de la plata. Por ejemplo, la plata contenida en los minerales de plomo sale de la fundición junto con este último elemento y luego se separa mediante el proceso Parkes que será descrito más adelante.
La plata contenida en el mineral de cobre, no se separa en la fundición, pero en el refinado electrolítico del cobre, el metal precioso que originariamente se hallaba en el ánodo, cae al fondo de los tanques en el transcurso de la electrólisis, constituyendo el llamado “barro anódico”, de donde la plata se recupera como bullón por fundición.
2° Minerales de plata propiamente dichos
El procesamiento de estos minerales varía según el tipo de las gangas y el contenido de plata.
Cuando los minerales tienen ganga terrosa y poco metálica, si son “pobres”, pueden ser tratados por cianuración y los minerales “ricos” por amalgamación, empleando los procedimientos: Patio, Languasco, Washoe, Króhnke.
Si la ganga es estéril muy metálica, no es aconsejable el tratamiento por amalgamación o por cianuración, debido al consumo inútil de reactivos, tales como: mercurio y cianuro de sodio.
Lo más indicado en este caso es la cloruración con sal común, o sea el tostado clorurante de la mena. El cloruro de plata formado de esta manera puede ser lixiviado mediante los procedimientos: Patera, Kiss, Russel, Augustin y Holt- Dern.
El tratamiento corriente de sulfuros que contienen plata es casi enteramente por el proceso de flotación. Por ejemplo, las menas que contienen plomo-plata- cobre y zinc (Empresa Minera Pulacayo) se someten a la flotación selectiva flotando juntos en una primera etapa Pb-Ag-Cu, depresando las piritas y el zinc. En una segunda etapa se activa y se flota el zinc depresando la pirita. Para la separación de plomo y cobre, el concentrado Pb-Ag-Cu se somete a la flotación diferencial, se depresa la galena con un oxidante como bicromato de potasio y se flota el cobre con los reactivos convencionales.
Cuando la ganga es estéril muy metálica, también se puede aplicar el proceso de volatilización, que se funda en la facilidad con que se volatilizan ciertos cloruros metálicos por acción del cloro.
3° Matas de cobre argentíferos
Tostado sulfatante y disolución del sulfato de plata. El proceso introducido en 1841 por Ziervogel, depende del hecho que la plata en compuestos de plata, cobre y sulfuros de hierro, pueden, si no están presentes en grandes cantidades ser convertidos en sulfato de plata mediante una cuidadosa tostación. Este sulfato de plata es soluble en agua caliente y de la solución acuosa la plata puede ser recuperada por precipitación con cobre metálico.
El material a ser tratado por este proceso debe contener cobre, hierro y sulfuros de plata y debe estar libre de cualquier cantidad considerable de compuestos de plomo, arsénico, bismuto y antimonio.
