Estos procedimientos son aplicables especialmente a aquellos minerales complejos que, debido a su compleja composición química, no pueden ser amalgamados directamente ni con el empleo de reactivos. En este grupo están aquellos minerales sulfurados en los que, junto a la plata, cobre, hierro y otros metales, se presentan el arsénico y el antimonio; o aquellos minerales que contienen una elevada proporción de galena, blenda, calcopirita, etc.
Casi la totalidad de los procedimientos de lixiviación de los minerales de plata comienzan con un tostado clorurante, con el objeto de poner este metal al estado de cloruro y hacerlo ASI SOLUBLE en los diversos reactivos:
1) Los procedimientos de lixiviación se distinguen todos en que los minerales son sometidos a la acción de un reactivo disolvente, separada después la solución rica en plata y luego precipitada la plata de esa solución con un reactivo específico para el caso.
TOSTACION CLORURANTE
La transformación de la plata en cloruro por medio del tostado clorurante es una operación fácil de practicar, pero está expuesta a pérdidas del metal si no se realiza con el debido cuidado y de acuerdo con la composición química del mineral.
El reactivo empleado en la cloruración es el cloruro de sodio, debido a su abundancia y baratura.
El cloruro de sodio es descompuesto por el anhídrido sulfúrico proveniente del tostado de las piritas y otros sulfures, con formación de sulfato de sodio y cloro libre, si es que no hay agua presente; y de ácido clorhídrico, si dentro del horno hay vapor de agua.
2NaCl + 2SO3 = Na2SO4 + SO2 + Cl2
Por efecto combinado de la sílice y del oxígeno, a temperaturas relativamente altas, sobre el cloruro de sodio, como indica la ecuación:
2NaCl + SiO2 + ½O2 = Na2SiO3 + Cl2
Descomponiendo por el calor un cloruro, en contacto con el aire o fuera de él, así:
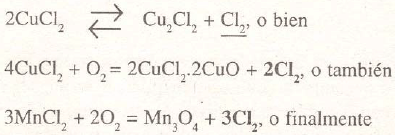
3FeCl3 + 2O2 = Fe3O4 + 3Cl2. El cloro en estado naciente que resulta de todas las reacciones expresadas, tiene poca acción sobre los óxidos metálicos, pero sí la ejerce sobre los metales, así como sobre los sulfures, arseniuros y antimoniuros. Por ejemplo, Ag + Cl = AgCl; Au + 3Cl = AuCl3
Se obtiene el ácido clorhídrico: 1) Por la acción del anhídrido sulfúrico, de un sulfato o de la sílice sobre el cloruro de sodio, en presencia del vapor de agua, como indican las ecuaciones siguientes:
2NaCl + 2SO3 + H2O = Na2SO4 + 2HCl
2NaCl + MgSO4 + H2O = Na2SO4 + MgO + 2HCl
2NaCl + SiO2 + H2O = Na2SiO3 + 2HCl
2) Por la acción del vapor de agua sobre un cloruro, originando óxido y ácido clorhídrico; 3) Por acción del cloro sobre un hidrocarburo, que dará lugar al ácido y carbono libre, el cual en contacto del aire se transforma en anhídrido carbónico. Ejemplos:
Práctica del tostado clorurante
Como regla general, los minerales deben ser finamente molidos para obtener mejor resultado. La molienda se efectúa en seco.
La cantidad de sal necesaria para el tostado depende de la naturaleza de las substancias extrañas que el mineral contiene y de la manera como se ha de conducir la operación y debe ser la suficiente para convertir toda la plata en cloruro. Los minerales que contienen mucha pirita o calcopirita requieren más sal por las reacciones de estos minerales sobre el cloruro de sodio.
La proporción de sal necesaria puede variar desde el 3% hasta el 20% como máximo que pocas veces se alcanza.
De ordinario, cabe distinguir dos fases en la tostación clorurante: una preliminar, que suele ser más o menos “sulfatante” y otra final, en que se verifica la cloruración.
La tostación clorurante puede originar pérdidas importantes de metal, en razón de que los cloruros de los metales de valencia inferior se volatilizan a temperaturas relativamente bajas y, si bien el cloruro de plata no es volátil a la temperatura de tostación, es arrastrado en mayor o menor cantidad- por los otros, lo que en último término equivale a su volatilización.
Hornos que se emplean en el tostado clorurante
Prácticamente todos los tipos de hornos de tostación pueden ser empleados en el tostados clorurante. Los hornos más Conocidos son: los hornos de reverbero; hornos de tambor giratorio; hornos circulares del tipo Mac-Dougall, modificados en los modelos modernos en el Herreshoff y el Wedge, pueden ser también empleados para el tostado clorurante. Los hornos especialmente diseñados para el tostado clorurante son varios, distinguiéndose el Merton y el Edwards, el horno Stetefeldt y el moderno Holt-Dern.
Tostación clorurante en la “Planta de Lixiviación” del Ingenio “Machacamarca” – Oruro, Bolivia.
Esta planta de lixiviación de plata ha dejado de operar desde el año 1957. El cuadro que se presenta a continuación es un ejemplo del comportamiento de los diferentes hornos en la tostación clorurante de una mena compuesta de pirita, pequeñas cantidades de galena, franckeita y estefanita en pizarra, en el Ingenio Machacamarca,a 3.700 metros sobre el nivel del mar.

Cantidad de MOCOS: aproximadamente 300 tons/año con 15 DM Ag. Capacidad de los buzones para mena fina, para tostación: 750 tons.
En Oruro, Bolivia, se ha comprobado que la temperatura para una cloruración óptima está entre 400 y 450°C. Si la temperatura sube a más de 500°C los resultados que se obtienen son cada vez peores. La razón para que la cloruración a 3.700 metros sobre el nivel del mar, se efectúe a temperaturas menores que las dadas en los libros técnicos es que, con la altura, la temperatura de evaporación disminuye y, en consecuencia, tanto las reacciones de cloruración y la volatilización de los cloruros de los metales comunes formados, se efectúan a bajas temperaturas.
En 1942 la Universidad “Tomás Frias” de Potosí, publicó un trabajo de investigación titulado: “Volatilización y Condensación de los Metales en la Altura”, escrito por el Dr. Esteban Szegedy, con la colaboración de los alumnos R. Salazar R. y J. Vargas G.
FORMULA DEL “RESIDUO” -METODO PARA LA DETERMINACION DE LA CANTIDAD DE CLORURO DE PLATA EN LA MENA CLORURADA POR TOSTACION CON NaCl
Se pesa 10 gramos de muestra no molida y se hace hervir durante un minuto con 100 cc. de agua potable. Se filtra y se lava 3 veces. Luego se lava la mena del filtro con un chorro de agua al mismo frasco, seguidamente se añade 100 cc. de agua potable y 20 cc. de amoniaco concentrado. Se calienta y se deja hervir por 2 minutos. Se filtra a través del mismo filtro, se quema y se ensaya la plata por los métodos convencionales, tomando para el efecto, 2 gramos de la muestra lixiviada.
Por este método, toda la plata que está presente como cloruro de plata (AgCl) se disuelve, pero los antimoniatos, óxidos o plata metálica, que son solubles parcial y lentamente en tiosulfato de sodio, no son disueltos.
EL COLOR DEL MATERIAL DESCARGADO DEL HORNO
El color de la descarga del horno es un buen indicador del grado de tostación y cloruración. Un color negro obscuro de la descarga del horno (Fe3O4) es un aviso de que la tostación no es suficiente y consecuentemente, la cloruración es mala.
Un color rojo (Fe2O3) indica una buena tostación y cloruración.
PROCEDIMIENTO PATERA
El uso de tiosulfatos como disolventes del cloruro de plata fue sugerido por Hauch en 1846 y por Percy en 1850, pero PATERA fue el primero en introducir su empleo en gran escala en las minas de JOACHIMSTHAL en Boemia en 1858. Se basa en el hecho de que el “cloruro de plata”es insoluble en agua y soluble en hiposulfito de sodio; y que de esta última solución rica puede ser precipitada la plata al estado de sulfuro por la acción del sulfuro de sodio o calcio.
De acuerdo con Russell, el poder disolvente del tiosulfato para el cloruro de plata es 100 veces más grande que el de la sal común. Esto es, 100 partes de tiosulfato (Na2S2O3·5H2O) de sodio disuelve 40 partes de cloruro de plata y la misma cantidad de sal común solamente disuelve 0,4 partes de cloruro.
El procedimiento consta de las siguientes operaciones unitarias:
– Molienda fina como operación previa para el tratamiento posterior.
– Tostado clorurante, para poner la plata al estado de cloruro de plata.
– Lavado preliminar con agua para eliminar los cloruros metálicos y otras sales solubles en agua.
– Lixiviación con hiposulfito de sodio para disolver la plata.
– Precipitación de la plata al estado de sulfuro, empleando como agente precipitante el sulfuro de sodio o de calcio.
– Tratamiento del precipitado de sulfuro de plata para obtener la plata metálica.
Para que los resultados sean buenos con el procedimiento Patera, la mena argentífera no debe ser muy rica en plomo, cobre o material calcáreo.
La acción dañina del plomo se hace evidente porque durante el tostado este metal se convierte en cloruro o sulfato (2NaCl + PbS + 2O2 = Na2SO4 + PbCl2), los cuales se funden y envuelven las partículas de mineral no descompuesto, para entrar después en disolución junto con la plata. Al final, el plomó se precipita junto con la plata al estado de sulfuro.
El cobre igualmente se disuelve y se precipita junto con la plata, impurificando este metal. El cobre es más nocivo cuando se encuentra asociado al plomo en los minerales, en razón de que la plata es más difícil separarla de un precipitado que contiene al mismo tiempo ambos metales, que cuando sólo contiene sulfuro de plomo o de cobre.
El arsénico y el antimonio no son dañinos durante la lixiviación, ya que el hiposulfito disuelve la plata de los arseniatos y antimoniatos que se pueden formar durante el tostado. Sin embargo, las combinaciones arsenio-sulfuradas o antimonio-sulfuradas que no hayan sido descompuestas por el tostado, no son atacadas por el hiposulfito. La caliza se transforma en cal viva durante la tostación; ésta actúa como reductor del cloruro de plata y disminuye su solubilidad en el hiposulfito, debilitando su tendencia a formar sales dobles. Además precipita el plomo como hidróxido, el cual forma alrededor del cloruro de plata una película densa insoluble en los hiposulfítos.
A objeto de impedir en parte los efectos nocivos del plomo y del cobre, se lava el mineral con agua caliente antes de someter a la lixiviación. El plomo puede también ser precipitado por el carbonato de sodio.
Extracción de compuestos solubles de metales comunes por medio del agua
En las menas que han sufrido una tostación clorurante, ciertas sales de los metales comunes serán solubles en agua, principalmente los sulfatos y cloruros de cobre, hierro y zinc, así como también el cloruro de plomo.
El lavado preliminar con agua y la lixiviación con hiposulfito se practica en las mismas tinas o cubas que son de madera y están provistas de un falso fondo. La capacidad varía de 10 a 50 toneladas, siendo más rápida la lixiviación en las tinas de gran capacidad. El diámetro varía entre 2,50 y 5,0 metros y profundidad entre 0.90 y 2,10 metros. Hofmnan sostiene que la mayor profundidad para tinas de lixiviación es de 1,07 m. a 1,22 m., siendo el espesor de la carga de mena de 0,61 a 0,76 metros. Este autor indica que la cantidad de cloruros disueltos por el disolvente en baños profundos viene a ser tan considerable que una buena cantidad de cloruro de plata es disuelto.
Las duelas que forman las paredes de la tina son de 76 mm. de espesor; el fondo tiene 10 centímetros de grueso; los anillos de sostenimiento son de hierro redondo de 25 mm. y las junturas son calafateadas con blanco de plomo, que es inatacable por el hiposulfito.
El fondo filtrante es una estera sobre la cual se coloca el filtro propiamente dicho que es una lona gruesa, todo lo cual descansa sobre listones de madera de 38 milímetros de alto y 25 de ancho, separados unos de otros por un espacio de 25 mm. y asegurados al fondo de la tina con tornillos recubiertos cort blanco de plomo.
Para que el líquido pueda circular sobre el fondo de la tina, los listones están provistos en su faz inferior de muescas de 12 mm. de alto y 76 de ancho. Los listones o tablillas no llegan del todo hasta la pared de la tina, sino que dejan un espacio libre de 38 mm., en el cual, vale decir en este espacio, se coloca un aro formado por varios listones, cerrando herméticamente la juntura con una cuerda de cáñamo. (Figs. 32,
33 y 34).
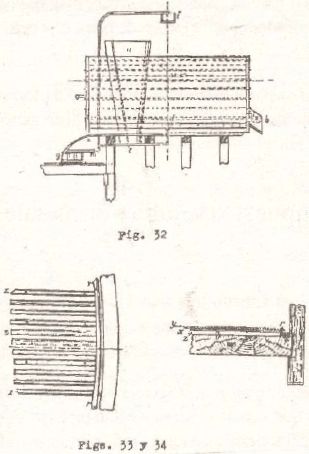
El mineral tostado se carga por medio de vagonetas que circulan por encima de las tinas. La descarga de las lejías se efectúa por un tubo de hierro adaptado al centro del fondo de la tina. Las tinas se llenan hasta una altura de 30 cc. del borde.
Las aguas del lavado preliminar son desechadas si no tienen valor, pero si han arrastrado algo de cloruro de plata, se hace necesario la precipitación con sulfuro de sodio. Si contiene cobre, puede precipitarse este metal empleando chatarra de hierro.
DISOLUCION DE LA PLATA EN EL HIPOSULFITO
Una vez terminado el lavado con agua para eliminar los cloruros metálicos y otras sales solubles en el líquido elemento, y cuando el nivel ha bajado hasta la superficie del mineral, se añade el hiposulfito de sodio abriendo el tubo de descarga de la tina de lixiviación para que el hiposulfito de plata se dirija hacia las tinas de precipitación. La salida del hiposulfito se constata con un papel almidonado y con yodo, el cual pierde su color azul en contacto con el hiposulfito.
Se entiende que la solución de hiposulfito de sodio tiene que percolar a través de la masa mineral hasta que en la solución que sale de la tina no haya vestigios de plata.
El cloruro de plata es disuelto por el hiposulfito de sodio según la siguiente ecuación química:
2AgCl + 3Na2S2O3 = Ag2S2O3, 2Na2S2O3 + 2NaCl
Una parte por peso de tiosulfato cristalizado (Na2S2O3 + 5H2O) disuelve 0,4 partes de cloruro de plata, correspondiente a 0,3 partes de plata metálica.
La solución de hiposulfito también disuelve la plata metálica, el óxido de plata, el oro, el arseniato y el antimoniato de plata.
De acuerdo a las investigaciones de Russell, 1 litro de solución de tiosulfato de sodio a temperatura normal, disuelve 0,03 gramos de plata metálica y la fuerza del disolvente, es la misma si la solución contiene 10, 25, 100, 150, 200 o 250 gramos de esta sal.
El óxido de plata se disuelve con formación de una sal doble:
3Na2S2O3 + Ag2O + H2O = 2Na2S2O3, Ag2S2O3 + 2NaOH
La presencia de 0,5% de NaOH en la solución de tiosulfato, según Russell, disminuye en un 30% su capacidad para disolver el cloruro de plata. Igualmente, la cal disminuye en 11 a 24% dicha capacidad.
En concreto, entre los otros cuerpos que se encuentran generalmente en la mena son solubles en el hiposulfito, el cobre, el óxido cuproso, el carbonato de cobre y el cloruro cuproso. En cambio, son insolubles los carbonatos de plomo, hierro, zinc y calcio, el óxido cúprico y los óxidos de hierro, manganeso y zinc. Son solubles el sulfato de plomo, el sulfato de calcio. Debido a estas solubilidades cuando la mena contiene plomo o cobre, estos metales se disuelven en el hiposulfito en la forma de sulfato de plomo y el cloruro cuproso que no ha podido ser eliminado en el lavado preliminar por ser insoluble en agua.
Según las investigaciones de Russell, un litro de solución de tiosulfato de sodio a la temperatura ordinaria y a una concentración de 2,5% del compuesto, disuelve 0,0002 gramos de oro metálico formando el oro una sal doble de la fórmula:
3Na2S2O3, AUS2O3 + 4H2O
De acuerdo con Hofmann la mejor concentración de la solución de tiosulfato es de 0,25 a 0,5% del compuesto. La disolución según los casos dura de 10 a 50 horas; y la operación continuará hasta que en la mena quede sólo indicios de plata.
Para conocer si la solución de hiposulfito contiene aún plata, se procede de la siguiente manera:
Se añade a la solución sulfuro de sodio y los sulfuras que se precipiten se disuelven en ácido nítrico y a esta solución se le agrega ácido clorhídrico y cloruro de sodio, que volverá a precipitar la plata y el plomo al estado de cloruros. Se tratarán estos por agua caliente, que disolverá el cloruro de plomo, dejando sin disolver el cloruro de plata si lo hubiera.
PRECIPITACION DE LA PLATA
La solución de tiosulfato de sodio contiene además de la plata, plomo, cobre oro, antimonio, arsénico y calcio. Los demás elementos, tales como zinc, hierro y manganeso, han sido eliminados en el lavado con agua. El plomo contenido en la solución está al estado de sulfato, pues la mayor parte del cloruro ha sido también eliminado por el lavado con agua.
Si una cantidad grande de plomo está presente en la solución de tiosulfato, es aconsejable precipitarlo como carbonato con carbonato de sodio, antes de precipitar la plata como sulfuro.
Para efectuar la precipitación se emplea el sulfuro de sodio en solución acuosa. La reacción es la siguiente:
Ag2S2O3 + 2(Na2S2O3) + Na2S = Ag2S + 3(Na2S2O3)
Se obtiene de esta manera el sulfuro de plata, mientras el hiposulfito de sodio es regenerado.
Junto con la plata se precipita también el oro, cobre y los demás metales pesados contenidos en la solución. No conviene emplear más sulfuro de sodio que el que es absolutamente necesario para la precipitación de los metales en cuestión, ya que la solución separada del precipitado debe servir otra vez para la lixiviación de la mena fresca. Si esa solución contuviera un exceso de sulfuro de sodio, este reactivo precipitaría la plata al estado de sulfuro insoluble en las cubas de lixiviación, lo que ocasionaría pérdidas del metal. Cualquier sulfuro de sodio presente en la solución debe ser destruido agregando una solución fresca de tiosulfato argentífero.
Las cubas de precipitación son de madera, de 3 m. de diámetro por 2,70 m. de profundidad. Durante la precipitación se agita el líquido por medio de paletas de madera o por agitadores mecánicos. Las figuras 35 y 36 muestran la disposición de la tina de precipitación con cañería de hierro de salida ab, el brazo b pasa a través de un cajón de relleno x en el lado de la tina y está conectado con la cañería de descarga c. Por medio de la palanca d, el tubo acodado y la porción a, pueden ser movidos por un ángulo de 90° con respecto a la línea vertical, de modo que el líquido puede ser descargado de cualquier profundidad, debiendo asegurarse la cañería en el ángulo requerido por la palanca d y el cuadrante f.
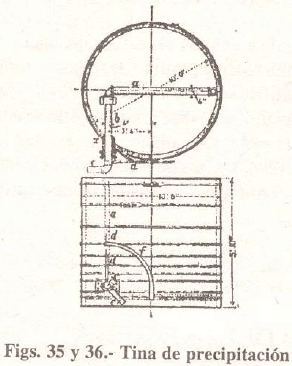
Cuando se desea precipitar el plomo con carbonato de sodio, antes de precipitar la plata, es necesario disponer una segunda cuba de precipitación igual a la descrita.
Para preparar el sulfuro de sodio se disuelve soda cáustica (NaOH) en una tina de hierro en una cantidad de agua igual a su peso, se calienta a 80°C y se introduce porciones de azufre en polvo. El azufre se disuelve en algunos minutos en la soda cáustica. Para 100 partes de soda se agrega 66 partes de azufre. Al agregar este elemento en la tina que contiene la solución de soda cáustica, aumenta mucho el volumen de la solución, por lo cual la tina no debe al principio ser llenada a más de ¼ de su altura. El sulfuro de sodio es retirado de las tinas y depositado en moldes, en los que se solidifica.
El consumo de hiposulfito de sodio se estima en 1 a 2 kilogramos por tonelada de mena tratada.
En lugar se sulfuro de sodio se emplea también comúnmente el sulfuro de calcio o mejor polisulfuro de calcio, que se obtiene haciendo actuar azufre en polvo sobre lechada de cal en un tanque de acero. La cal viva se disuelve en agua hirviendo y por cada 1,5 partes de cal se agrega una parte de azufre triturado en molino de rollos, el proceso se termina después de 3 o 4 horas de ebullición. La reacción es:
3CaO + 3H2O + 12S = 2CaS5 + CaS2O3 + 3H2O
La razón por la cual se emplea el sulfuro de calcio como precipitante (Ej. Machacamarca, Bolivia) en lugar del sulfuro de sodio, es porque durante la tostación clorurante se forma sulfato de sodio poco soluble en el agua de lavado, por lo cual pasa después con el hiposulfito, lo que hace que este reactivo vaya perdiendo su poder disolvente sobre la plata. En cambio, si se emplea sulfuro de calcio como precipitante, reacciona con el sulfato de sodio, produciendo sulfato de calcio que se precipita totalmente, formándose al mismo tiempo sulfuro de sodio que sirve para precipitar la plata:
Na2SO4 + CaS = CaSO4 + Na2S
TRATAMIENTO DEL PRECIPITADO
Los sulfuros precipitados pueden contener además de la plata, cobre, plomo, arsénico, zinc, hierro y azufre libre.
La separación del precipitado argentífero se efectúa en un filtro prensa.
Para separar el azufre se trata el precipitado en una tina de hierro con soda cáustica caliente. Se produce sulfuro de sodio que se puede emplear como precipitante. También se puede tostar el precipitado en un horno pequeño de reverbero o calentar el precipitado para destilar el azufre, (en Machacamarca, Bolivia, se tostaba en un horno reverbero).
Para separar la plata de sus otras impurezas, se introduce el precipitado en un horno de copelación dentro de un baño de plomo.
Los hornos de copelación tienen por objeto recuperar la plata por fusión en corriente de aire; éste oxida el zinc, hierro, níquel, cobalto, estaño, antimonio, plomo, bismuto y cobre, quedándose la plata en la solera. La copelación se efectúa a una temperatura superior a la de fusión del óxido plúmbico, es decir, a más de 906°C. Los humos del hogar atraviesan el laboratorio del horno y funden la carga: una corriente de aire caliente atraviesa el horno lamiendo la superficie del baño y oxida los metales anteriormente nombrados, los cuales originan una escoria flotante que se extrae con hierros a propósito. El trabajo es intermitente. La capacidad de los hornos de copela alemanes es de 10 toneladas; la copelación se efectúa en 1,5 a 3 días. Los hornos ingleses son algo más pequeños, pero tienen solera de recambio.
Con el procedimiento PATERA se logra recuperar el 70 y el 90% de la plata contenida en la mena argentífera.
LIXIVIACION Y PRECIPITACION DE LA PLATA EN EL INGENIO “MACHACAMARCA, ORURO-BOLIVIA”
(Operación a 3.700 metros de altura sobre el nivel del mar)


Un flujograma sistemático de la lixiviación con hiposulfito de sodio y precipitación con sulfuro de calcio, se puede ver en la figura 37.
Algunas consideraciones teóricas de la lixiviación y precipitación de la plata en base a los productos de solubilidad
Ya sabemos que después de la tostación clorurante, la plata se disuelve por medio de solución de tiosulfato de sodio, formándose una sal compleja, el argentotiosulfato sódico, según:
AgCl + 2Na2S2O3 = [Ag(S2 O3)2] Na3 + NaCl
y después de filtrar se precipita la plata por sulfuro de sodio o calcio, regenerándose el tiosulfato inicial, según:
[ Ag(S2O3)2]Na3 + Na2S = Ag2S + 4Na2S2O3
En este procedimiento se solubilizan los cloruros porque la constante compleja expresada por:
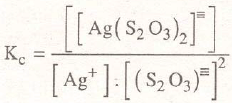
multiplicada por el producto de solubilidad del cloruro de plata:
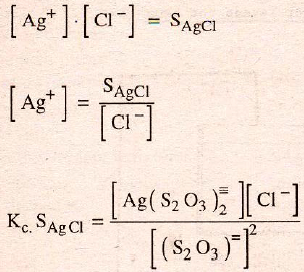
da un resultado grande, por lo cual para grandes concentraciones de (S2O3)= puede disolverse mucha plata hasta crear un valor demasiado elevado de [cl-]
La precipitación con sulfuro sódico ocurre porque el producto de solubilidad del sulfuro de plata:
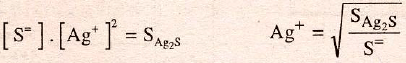
es mucho más pequeño y da un resultado pequeño a su producto con la constante compleja:
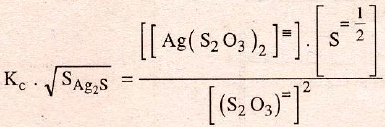
Los valores de los productos de solubilidad y de la constante compleja a temperatura ambiente, valen:
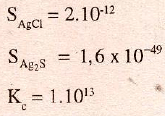
por lo que los productos de constantes, valen:
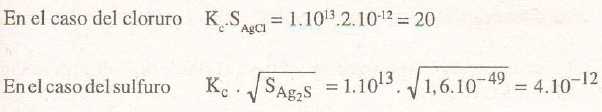
valores que justifican las afirmaciones anteriores.
CIANURACION DE LA PLATA
La cianuración es un procedimiento que consiste en disolver la plata metálica y minerales de plata en una solución de cianuro de sodio o potasio. Para las reacciones que se anotan a continuación, se tomará como solvente el cianuro de sodio.
La plata metálica se disuelve en cianuro de sodio en presencia de aire.
4Ag + 8NaCn + 2H2O + O2 = 4NaAg(CN)2 + 4NaOH
El cloruro de plata se disuelve con mucha rapidez, sin necesidad de oxígeno.
AgCl + 2NaCN = NaAg(CN)2 + NaCl
La mayoría de los minerales de plata se disuelven en la misma forma.
El sulfuro de plata se disuelve despacio y la reacción es reversible y requiere un exceso de cianuro.
![]()
En general, los telururos de plata son poco atacados por las soluciones de cianuro.
El precipitante ideal de plata de las soluciones de cianuro, sería el sodio metálico, con regeneración total del cianuro.
Na + NaAg(CN)2 = Ag + 2NaCN
En la precipitación con aluminio hay una completa regeneración del cianuro de sodio:
Al + 3NaAg(CN)2 + 3NaOH = 6NaCN + 3Ag + Al(OH)3
La precipitación con polvo de zinc se lleva a cabo de acuerdo al procedimiento MERRILL-CROWE.
Zn + 2NaAg(CN)2 = Na2Zn(CN)4 + 2Ag
En el Centro de Investigación Metalúrgica de Reno, Nevada, del Bureau of Mines se ha investigado sobre la extracción de la plata de los recursos marginales, vale decir, de los desmontes y menas refractarias de baja ley en plata. Una técnica desarrollada en dicho centro involucra la precipitación selectiva de la plata como sulfuro de plata (Ag2S) de las soluciones provenientes de la cianuración, seguido por la recuperación del oro residual sobre carbón activado. La cianuración de la plata por el método de “carbón en pulpa” parece prometedor para el tratamiento de colas lamosas, con el plata del carbón cargado, con soluciones de etanol alcalino a la temperatura ambiente y presión.
La cianuración de una mena argentífera refractaria, previa tostación clorurante con sal común para convertir la plata en cloruro de plata, dio excelentes resultados ya que se obtuvo una recuperación del 88% comparado con el 60% alcanzado por cianuración convencional. El material clorurado puede ser procesado por percolación en tinas o por lixiviación en pilas, empleando una solución diluida en cianuro.
La plata se puede recuperar también de la disolución lixiviadora, por depósito electrolítico.
El precipitado se somete a la refinación; si es muy rico en plata se funde directamente en crisoles con bórax, pero generalmente se trata con ácido sulfúrico para eliminar el zinc y a veces se somete a la tostación con el mismo objeto. Los fundentes que se emplean son: bórax, cenizas de soda (soda ash), sílice, etc. El litargirio (PbO) se emplea cuando la copelación es la etapa final del proceso de refinación.
La extracción de la plata por cianuración es un proceso análogo al de la disolución por tiosulfato, justificado por los valores de la constante compleja:
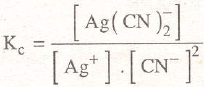
y por los productos de solubilidad:
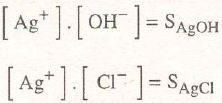
que en este caso toman los valores:
![]()
Por tanto:
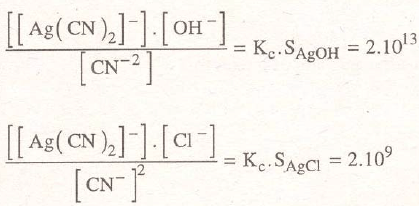
Por lo que el cianuro de sodio disuelve espléndidamente bien al cloruro de plata y a la plata nativa que, por oxidación, estará en equilibrio con hidróxido de plata, según:
![]()
Al aplicar similar teoría al sulfuro, según la reacción:
Ag2S + 4NaCN + 2O2 — 2[ Ag(CN)2 ] Na + Na2SO4SO3
Nos encontramos con el valor:
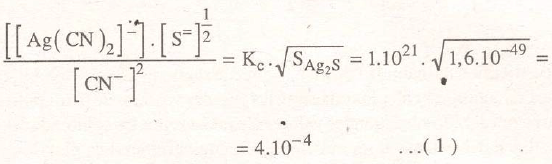
Valor que nos daría una insignificante insolubilidad. Se consigue solubilizar el sulfuro de plata añadiendo acetato de plomo, cuyo plomo precipita al S=, de acuerdo a:
Pb++ + S= → PbS
con un valor de su producto de solubilidad de:
[Pb++].[S=] = SpbS=1.10.29
despejando S», se tiene:
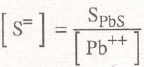
extrayendo la raíz cuadrada de ambos miembros:
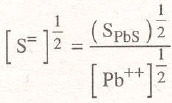
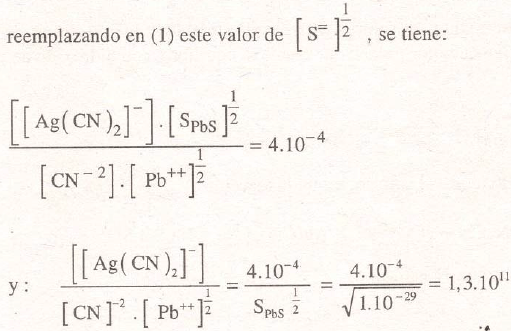
por lo que con suficiente cantidad de Pb++ se puede lograr una buena solubilización de la plata. Los anteriores cálculos muestran las grandes ventajas de la solubilización por cianuración, debido a los grandes valores alcanzados por las solubilidades y por la universalidad del sistema al ser aplicable a cualquier mineral de plata.
PROCEDIMIENTO RUSSELL
Este procedimiento consiste en disolver por medio de una solución de hiposulfito doble de sodio y cobre la plata contenida en el sulfuro y en los compuestos que contienen arsénico y antimonio.
Se ha empleado más como procedimiento auxiliar del procedimiento PATERA, para tratar los residuos dejados por este último proceso que puedan contener aún minerales argentíferos inertes al hiposulfito de sodio, que hayan podido quedar después del tostado clorurante. El cloruro de plata es disuelto en pequeñísimas cantidades y más despacio por el tiosulfato doble de sodio y cobre que por el tiosulfato de sodio.
Hay varios tiosulfatos de sodio y cobre, y se obtienen mezclando las soluciones de tiosulfato de sodio y el sulfato de cobre; estas sales dobles se separan como precipitados de color amarillo, cuando las soluciones no demasiado diluidas de ambas sales son mezcladas. La sal obtenida de este modo por LENZ tiene la siguiente fórmula:
2Na2S2O3, 3Cu2S2S3 + 5H2O
El hiposulfato doble preparado según la ecuación:
11Na2S2O3 + 6CuSO4 = 2Na2S2O3, 3Cu2S2S3 + 6Na2SO4 +3Na2S4O6
es muy poco soluble en agua, pues una parte exige 352 partes de agua, pero se disuelve fácilmente en las soluciones de hiposulfito de sodio. De aquí que Russell admite que se forma una sal doble de la fórmula:
4Na2S2O3, 3Cu2S2O3 + XH2O
la cual es fácilmente soluble. Esta sal se forma mezclando la solución de sulfato de cobre y tiosulfato de sodio, de acuerdo a la ecuación:
13Na2S2O3 + 6CuSO4 = 2Na2S2O3, 3Cu2S2O3 + 6Na2SO4+ 3Na2S4O6
y es una solución de esta sal: 4Na2S2O3, 3Cu2S2O3 + XH20 la misma que lleva el nombre de “solución Russell” o “solución extra”.
La solución Russell tiene sobre la plata un poder disolvente, 9 veces mayor que el hiposulfito de sodio a la temperatura ordinaria. El oro metálico es disuelto con la misma facilidad que por el hiposulfito. El sulfuro de plata es rápidamente descompuesto por la sal, disolviéndose la plata y separándose sulfuro de cobre, de acuerdo a la reacción química:
Ag2S + Na2S2O3, Cu2S2O3 = Na2S2O3, Ag2S2O3 + Cu2S
y la disolución de la plata metálica y la solución está representada por la ecuación:
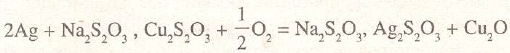
el sulfuro de oro es igualmente descompuesto, disolviéndose el oro y separándose sulfuro de cobre.
Los arseniatos y antimoniatos de plata son tan fácilmente descompuestos como por una solución simple de hiposulfito de sodio.
La solución Russell no es regenerada por el tratamiento mismo, pues el cobre es precipitado junto con la plata; consecuentemente, debe ser preparada para cada lixiviación, y esto, en el momento de utilizar, porque se descompone en contacto con el aire.
El procedimiento Russell comparado con el “Patera”, tiene como principales desventajas, el costo alto de los reactivos, la planta es más complicada, la producción de plata es pequeña y se requiere trabajadores más entrenados. Estas desventajas han limitado su empleo.
El procedimiento Russell completo, consta de las siguientes operaciones unitarias:
1. Molienda y tostado clorurante.
2. Lavado con agua.
3. Lixiviación con hiposulfito de sodio.
4. Lixiviación de los residuos con el hiposulfito doble de sodio y cobre, para disolver la plata contenida en las especies minerales no atacádas.
5. Precipitación por el polisulfuro de calcio.
6. Tratamiento del sulfuro de plata.
PROCEDIMIENTO KISS
Este procedimiento es tan solo una variante del procedimiento Patera, que consiste en emplear como disolvente el hiposulfito de calcio en lugar del hiposulfito de sodio, y precipitar enseguida con el sulfuro de calcio, regenerando el hiposulfito de calcio.
Las diversas etapas que se siguen en este procedimiento son:
1. Tostado clorurante.
2. Lavado con agua.
3. Disolución del cloruro de plata en hiposulfito de calcio:
2AgCl + 3CaS2O3 = Ag2Ca2(S2O3)3 + CaCl2
4. Precipitación por el polisulfuro de calcio:
Ag2Ca2(S2O3)3 + CaSx = Ag2S + CaS2O3 + S x-1
5. Tratamiento del sulfuro de plata para obtener plata metálica.
El hiposulfito de calcio se produce haciendo pasar el dióxido de azufre por la solución de sulfuro de calcio, así:
Ca2S5 + 3SO2 = 2CaS2O3 + 2S2
o por oxidación espontánea del sulfuro de calcio en el aire.
2CaS5 + 3O2 = 2CaS2O3 + 3S2
La ventaja que se atribuía al procedimiento Kiss era la de que el hiposulfito de calcio se creía mejor disolvente del cloruro de oro que el hiposulfito de sodio. Esta afirmación no ha sido comprobada.
El procedimiento Kiss ofrece las siguientes desventajas:
1. El poder disolvente del hiposulfito de calcio sobre el cloruro de plata es ligeramente menor que el del hiposulfito de sodio.
2. El hiposulfito de calcio se descompone más rápidamente que el de sodio, transformándose en sulfato de calcio.
3. El sulfato de sodio que se produce durante el tostado, actúa sobre el hiposulfito de calcio, formando sulfato de calcio, que se elimina con las colas e hiposulfito de calcio que continúa actuando en la solución con lo cual, después de un tiempo, el disolvente está constituido por el hiposulfito de sodio, como en el procedimiento Patera.
La recuperación de plata por este procedimiento es del 70 al 85 %.
Las soluciones de tiosulfato de calcio se descomponen más rápidamente que aquellas de tiosulfato de sodio, con el oxígeno del aire, formando sulfato de calcio.
Stetefeldt, ha demostrado que 1,4 y 16,1 %, respectivamente, de las soluciones de tiosulfato de sodio y calcio, originalmente de la misma concentración, fueron descompuestas, dejando en reposo, en una semana.
PROCEDIMIENTO ZIERVOGEL
Este procedimiento fue introducido en 1841 por Ziervogel en Gottesbelohnungshütte, Hettstadt, donde desempeñaba el cargo de Gerente; para obtener la plata de las matas de cobre.
El proceso depende del hecho de que la plata en compuesto de plata, cobre y sulfuro de hierro, puede, si no está presente en grandes cantidades, ser convertida en sulfato de plata mediante una cuidadosa tostación. Este sulfato de plata es soluble en agua caliente y de su solución acuosa, la plata puede ser precipitada por cobre metálico.
El procedimiento Ziervogel, se usa principalmente para matas de cobre, libres de arsénico, antimonio, bismuto y plomo y que no contenga un porcentaje de plata demasiado alto.
Las menas no son procesadas por el procedimiento Ziervogel, en razón de que aquellas no poseen nunca el grado de dureza requerido.
La solubilidad de sulfato de plata, según Rammelsberg, es la siguiente:
1 parte de sulfato de plata se disuelve en 180 partes de agua fría.
1 parte de sulfato de plata se disuelve en 88 partes de agua hirviendo.
1 parte de sulfato de plata se disuelve en 180 partes de ácido sulfúrico de 10 °Bé.
PROCEDIMIENTO AUGUSTIN
En este procedimiento después de la tostación clorurante, se emplea como disolvente del cloruro de plata, una solución concentrada y caliente de cloruro de sodio. La plata así disuelta se precipita por medio del cobre, el cual a su vez se precipita con hierro.
La lixiviación de la plata con salmuera, empezó en Alemania, con el proceso Augustín en 1843 y continuó su empleo en Hungría para la recuperación de la plata de las matas hasta 1893. En 1911 este proceso fue revivido por el procedimiento Holt-Dern, desarrollado en Park City, Utah, USA, que alcanzó en 1914 operaciones de tipo comercial.
De acuerdo a Russell, 100 partes de cloruro de sodio sólido disuelto en agua, disuelven 0,4 partes de cloruro de plata. Según A. Vogel, un litro de solución saturada de sal común, disuelve 0,95 gramos de cloruro de plata, a la temperatura ordinaria o 1,27 gramos a 19,6°C, según H.C. Hahn y W.M.Curtis.
Este procedimiento, como ya se ha mencionado anteriormente, se basa en la solubilidad del cloruro de plata en una solución concentrada y caliente de cloruro de sodio. Sin embargo, el hecho de que esta solubilidad es relativamente débil, ha hecho que este procedimiento fuera poco empleado aisladamente, aun cuando lo fuera en combinación con otros procedimientos, tales como Patera.
Para disolver una parte de cloruro de plata, se requiere 68 partes de cloruro de sodio, mientras que bastan dos partes de hiposulfito para disolver una de cloruro de plata.
En el procedimiento Augustín, la plata se precipita al estado metálico, mientras que en el proceso Patera, la plata se obtiene al estado de sulfuro, lo que implica nuevos tratamientos del precipitado para obtener plata metálica.
La mena tostada se somete a la acción disolvente del cloruro de sodio en solución caliente, pero si hubiera plomo, sería preciso lavarlo previamente con agua caliente para evitar que este metal se precipite después junto con la plata.
Cuando la plata ha sido ya precipitada, la solución queda cargada de cobre, para recuperar el cual se le hace pasar por una serie de tanques llenos de trozos de chatarra de hierro.
La presencia de cal y magnesia eñ la mena es perjudicial ya que estos se combinan con el azufre impidiendo la cloruración en el horno de tostación; estos también consumen el ácido en las soluciones de lixiviación y tienen una acción precipitante sobre los cloruros de los metales comunes.
Tanto el lavado con agua caliente como la disolución en el cloruro de sodio se lleva a cabo en linas de madera con parrillas de madera en el fondo sobre el cual se coloca la materia filtrante.
La precipitación se efectúa en tinas similares a las de lixiviación, las cuales se disponen en cascada, de manera que la solución las atraviese sucesivamente.
PROCEDIMIENTO HOLT-DERN
El procedimiento Holt-Dern es la versión moderna del procedimiento Augustín. El procedimiento Holt-Dern fue desarrollado en 1911 en ParkCity, Utah, alcanzando la etapa de operación comercial en 1914. En 1915 fue construida una planta en Silver City, Utah, por la Compañía “Tintic Milling Co.”.
En este procedimiento primeramente se realiza una tostación clorurante, después la lixiviación por la solución caliente de sal común (NaCl) y por último la precipitación por el cobre. Las modificaciones con respecto al procedimiento Augustín son de orden mecánico y químico. Las reformas de orden mecánico consisten en que el tostado se efectúa en el moderno horno Holt-Dern, y que la lixiviación empieza en los canales que conducen el mineral tostado a las tinas. La principal modificación de orden químico consiste en que el líquido disolvente contiene además del cloruro de sodio, cierta cantidad de ácido sulfúrico que facilita la lixiviación. Otra modificación consiste en que el plomo no es lavado previamente como precipitado de la solución, después de haberlo sido la plata y el cobre.
En resumen, el procedimiento Holt-Dern consta de las siguientes operaciones unitarias:
1. Trituración y molienda.
2. Tostado clorurante.
3. Lixiviación por solución caliente y concentrada de cloruro de sodio, acidulada con ácido sulfúrico.
4. Precipitación de la plata por el cobre.
5. Precipitación del cobre por el hierro metálico, en frío.
6. Precipitación del plomo por el hierro metálico, en caliente.
7. Lavado del precipitado de plata.
8. Tostado del precipitado de plata.
9. Lavado del material tostado con ácido sulfúrico.
10. Refinación de la plata.
La molienda se efectúa hasta que la mena pase la malla N° 10 (1,8 mm. de abertura) y agregando durante la operación un 8 a 10% de cloruro de sodio.
El tostado se realiza en los hornos Holt-Dern. La mena debe tener alrededor de 3% de azufre, en razón de que una proporción menor hace que la carga arda desigualmente y si esa proporción excede de 4% puede fundirse en el horno y no realizarse la cloruración. Según la cantidad de azufre presente se añade carbón en proporción de 1 a 2% y además agua en proporción de 7%, aproximadamente, pues esta contribuye a la formación de ácido clorhídrico que ayuda la operación y a dejar la mena tostada en forma de una masa porosa, lo cual facilita la lixiviación. En la práctica, con 3% de azufre, 1.5% de carbón fue agregado, pero como el azufre cambió, el porcentaje de carbón también fue variado, usando la relación azufre: carbón = 1: 0,65.
La lixiviación se inicia en los canales que conducen la mena tostada de los hornos a las tinas de lixiviación. Estos canales son de concreto y la mena al caer en ellos es arrastrada por la salmuera caliente y casi saturada, acidificada con 1 a 2 kg. de ácido sulfúrico por tonelada.
Los tanques son de concreto de 9 m. de diámetro y 3,5 m. de altura y están provistos de un fondo filtrante de cuarcita molida. La solución lixiviante al salir de los tanques es separada en dos partes: la primera, o sea la parte rica es llamada “solución preñada” que contiene casi toda la plata y el plomo, mientras que las últimas, conocidas como “solución débil” son muy pobres en estos metales y son utilizados para conducir una nueva porción de mena tostada a otro tanque.
Todo el ciclo de operación de disolución y lavado de un tanque, es como sigue: llenado de los tanques con material tostado, 24 horas: lixiviación con solución débil, 48 horas; lixiviación con solución agotada, 48 horas; lavado con agua, 8 horas; descargue, 2 horas; vaciado de los tanques, 8 horas. Total: 5 a 6 días de operación.
La precipitación de la plata se efectúa sobre cemento de cobre, en tanques de concreto con agitación por aire comprimido. Después de cierto tiempo la precipitación se paraliza en el primer tanque, probablemente por la precipitación de arsénico sobre el cemento de cobre; entonces se extrae la plata precipitada y el cobre del segundo tanque se pasa al primero.
El precipitado que se obtiene contendrá, además de la plata, algo de cobre, plomo, arsénico, antimonio, hierro, alúmina e insoluble. La ley en la plata puede oscilar alrededor del 30%.
La precipitación del cobre se efectúa tratando las aguas que salen del tanque en que se precipitó la plata, por medio del hierro metálico.
Para precipitar el plomo se trata las aguas que ya soltaron su cobre en un tanque, empleando como precipitante el hierro, pero calentando la solución a 75°C por medio de serpentines de vapor. Este precipitado contiene alrededor de 75% de plomo con cierta cantidad de cobre y plata.
En las localidades bolivianas de San Vicente y Pulacayo fueron instaladas plantas piloto incluyendo hornos Holt-Dern para la lixiviación de plata con solución de sal común, con el fin de reemplazar la lixiviación con hiposulfito de sodio en operación desde hace 30 años. El éxito de este proceso ha tenido que depender de la adaptación de la tostación a menas con alto contenido de azufre. Se intentó resolver este problema retornando una porción de la calcina al buzón de la carga para mezclar luego con la mena bruta, reduciendo de esta manera el contenido de azufre de la carga del horno. Los hornos fueron instalados en 1942-1943 bajo los auspicios del Board of Economic Warfare de los Estados Unidos. Los resultados en detalle de la operación de esas plantas no fueron revelados debido al secreto industrial que guardan las empresas en casos como este.
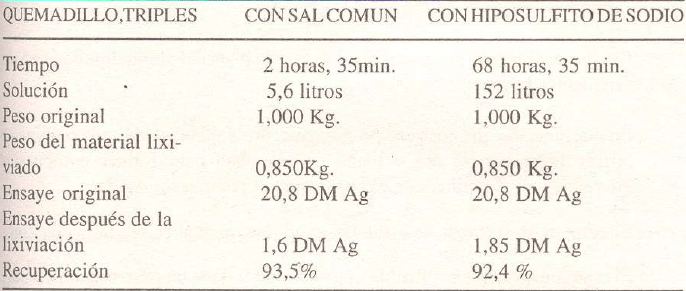
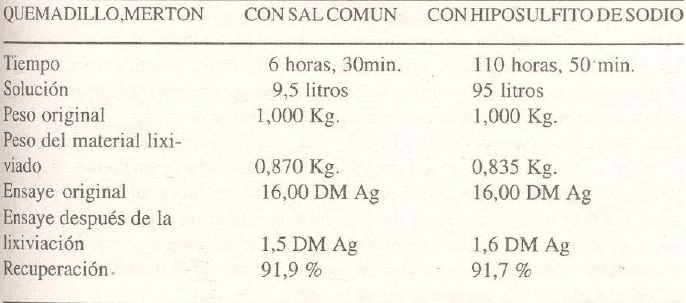
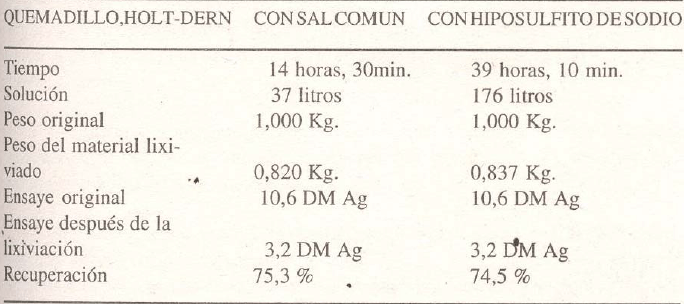
LIXIVIACION CON SALMUERA CALIENTE versus LIXIVIACION CON HIPOSULFITO
Estas pruebas comparativas de ambos métodos fueron realizadas en Machacamarca (Bolivia) por Mr. Bakels en 1934.
Para las pruebas se prepararon dos muestras iguales de los diferentes quemadillos (calcina); una de ellas fue lixiviada con hipo y la otra con salmuera caliente.
La concentración de la solución de cloruro de sodio era de 30% y la de hiposulfito, 1%.
PROCESO “PARKES”
Este procedimiento de separación del oro y la plata del plomo fundido se basa en los siguientes hechos:
En una aleación que contiene plomo, zinc, oro y plata, el zinc se combina en primer lugar con el oro y luego con la plata para formar compuestos intermetálicos. La plata con el zinc forma el compuesto Ag2Zn3.
El compuesto formado es insoluble en plomo, el cual es saturado con zinc.
El compuesto es menos fusible que el plomo y tiene un peso específico muy bajo.
El plomo fundido se licúa en un caldero y luego se añade de 1 a 2% de zinc metálico para formar un compuesto con la plata y para saturar el plomo con zinc. La aleación se mantiene a una temperatura de 480°C durante varias horas, tiempo en el que se va agitando para que la costra generalmente formada por plomo, cobre, antimonio, plata y oro, suba a la superficie en razón de su bajo peso específico. Esta costra se separa del plomo líquido y se somete a un aprensado fuerte para eliminar el exceso de plomo. La costra aprensada se carga en una retorta especial y luego de agregar una pequeña cantidad de carbón vegetal se sube la temperatura hasta 1,200°C, para volatilizar el zinc, el cual se recoge en un condensador de donde se saca para fundir y moldear en planchas para usar nuevamente en el proceso. El residuo de la destilación se moldea en barras y se somete al tratamiento en horno de copelación para la recuperación de la plata.
